
ĐÀO TẠO ĐGV NỘI BỘ ISO 9001:2015_BAI KIỂM TRA CUỐI KHÓA

ĐÀO TẠO NHẬN THỨC QLCL & HƯỚNG DẪN ÁP DỤNG TIÊU CHUẨN ISO 9001:2015

IBTC Đào tạo tại Doanh nghiệp

SƠ LƯỢC QUẢN LÝ Y TẾ THEO HỆ THỐNG VÀ VẬN DỤNG VÀO CƠ QUAN KIỂM NGHIỆM DƯỢC PHẨM, MỸ PHẨM, THỰC PHẨM
Tiêu chuẩn ISO 9000:2015 Hệ thống quản lý chất lượng _ Cơ sở và từ vựng, đưa ra các thuật ngữ và định nghĩa về hệ thống quản lý như sau:
Từ cách tiếp cận đó, hiểu về quản lý y tế theo quan điểm hệ thống, tức là, việc quản lý y tế được dựa trên các chính sách, mục tiêu và các quá trình quản lý hành chính, quản lý hoạt động tác nghiệp, quản lý chất lượng, quản lý kỹ thuật, …. cùng với các nguồn lực cần thiết, thích hợp, được thiết lập trong quan hệ tương tác, hỗ trợ lẫn nhau, sao cho, thông qua nó, cùng với quá trình tổ chức thực hiện theo từng quy mô, đặc điểm tổ chức khác nhau (cấp Bộ Y tế, cấp Sở Y tế, Y tế cơ sở,…) nhằm đạt được mục tiêu của ngành y tế đặt ra (mục tiêu tổng quát/ dài hạn và mục tiêu ngắn hạn trong từng thời kỳ, từng giai đoạn, bối cảnh cụ thể).
.jpg)
Kiểm nghiệm thuốc tân dược: định lượng hoạt chất chính bằng UV-Vis
Trung tâm Kiểm nghiệm Thuốc, Mỹ phẩm, Thực phẩm đã xây dựng, áp dụng Hệ thống quản lý năng lực phòng thí nghiệm theo tiêu chuẩn quốc tế ISO/IEC 17025:2017 (Tiêu chuẩn quốc gia TCVN ISO/IEC 17025:2017) nhằm chuẩn hóa các hoạt động kiểm nghiệm thuốc, mỹ phẩm, thực phẩm chức năng và cung cấp kết quả chính xác, khách quan, tin cậy đối với mẫu lấy hoặc mẫu gửi được kiểm nghiệm. Hệ thống quản lý này đã được Văn phòng công nhận chất lượng (BoA) thuộc Bộ Khoa học và Công nghệ đánh giá, cấp Giấy chứng nhận vào đầu năm 2021.
Hệ thống quản lý theo ISO/IEC 17025 được vận hành dựa trên ba trụ cột chính:
Một là, “Vận dụng chu trình PDCA” (Plan-Do-Check-Act)

Gồm: Lập kế hoạch – Tổ chức thực hiện – Theo dõi, kiểm tra, tổng hợp báo cáo, đánh giá – Khắc phục các tồn tại và cải tiến tốt hơn cho kỳ sau.
Do vậy, tất cả các hoạt động đều bắt đầu bằng công tác lập kế hoạch, tức là phải hoạch định, xây dựng kế hoạch phù hợp (ví dụ Kế hoạch lấy mẫu thuốc tân dược, đông dược, dược liệu,… gồm những loại mẫu gì, hoạt chất gì, số lượng, địa điểm, thời gian, người thực hiện,…) để chủ động phân công, chuẩn bị nguồn lực, tổ chức thực hiện đúng ngay từ đầu.
Tiếp đến là thực hiện lấy mẫu theo kế hoạch, lập biên bản lấy mẫu, bảo quản, vận chuyển mẫu, bàn giao mẫu, cập nhật kết quả thực hiện so với kế hoạch lấy mẫu,… xem xét rút kinh nghiệm, khắc phục cải tiến cho chu kỳ lập kế hoạch và lấy mẫu ở tháng tiếp theo.
Hai là, “Tiếp cận theo quá trình”
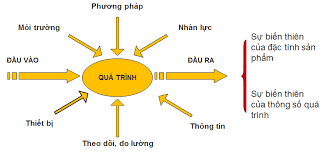
Gồm việc tiếp cận theo đầu vào, đầu ra của quá trình, quy trình thực hiện, mục tiêu của quá trình, nguồn lực cho quá trình, rủi ro của quá trình, người chịu trách nhiệm về quá trình,… nhờ đó mà mỗi hoạt động được tổ chức thực hiện bài bản, có hệ thống, kết nối nhau, đầu ra của quá trình này là đầu vào của quá trình tiếp theo. Điều này giúp cho đơn vị, người thực hiện chủ động công việc theo một mô thức thống nhất, được kiểm soát, nhất quán và kết quả đầu ra ổn định, thỏa theo yêu cầu của công tác quản lý chất lượng.
Cụ thể, Trung tâm, khi xây dựng, áp dụng ISO/IEC 17025 đã ban hành nhiều Quy trình (được cụ thể hóa từ các quá trình) như: Quy trình lấy mẫu (kể cả các hướng dẫn lấy mẫu); Quy trình bảo quản, vận chuyển, bàn giao mẫu; Quy trình lưu mẫu, theo dõi, thanh lý mẫu; …
Ba là, “Tư duy dựa trên rủi ro”

Gồm việc nhận biết, phân tích, đánh giá rủi ro các quá trình, xây dựng các phương án, biện pháp kiểm soát rủi ro, từ đó, chủ động phòng ngừa rủi ro, giảm thiệt hại (nếu có) và nhằm đạt được mục tiêu đề ra (bởi chính rủi ro làm cho tổ chức không đạt được mục tiêu đã định).
Cụ thể, Trung tâm đã xây dựng, ban hành Quy trình quản lý rủi ro, cơ hội và tổ chức thực hiện đánh giá rủi ro cho các hoạt động như: lấy mẫu, quản lý mẫu; quản lý thiết bị kiểm nghiệm; quản lý hóa chất dụng cụ kiểm nghiệm; lập và xuất phiếu kiểm nghiệm; … Nhờ đó, Trung tâm không bị động, bất ngờ về các hoạt động quản lý cũng như chuyên môn của mình.
Với việc áp dụng hệ thống quản lý ISO/IEC 17025, Trung tâm đã xây dựng, ban hành Chính sách quản lý phòng thí nghiệm, các mục tiêu, các quy trình, hướng dẫn công việc, các biểu mẫu … và phân công trách nhiệm quyền hạn rõ ràng, đảm bảo tay nghề của nhân sự thực hiện, cung cấp nguồn lực cần thiết và theo dõi điều chỉnh khi cần để chúng luôn thích hợp và nhằm hoàn thành vượt mức kế hoạch do Sở y tế giao hàng năm hoặc đột xuất.
(Chính sách quản lý phòng thí nghiệm)
Với chức năng, nhiệm vụ về kiểm tra, thử nghiệm, đánh giá chất lượng Thuốc và nguyên liệu thuốc, mỹ phẩm, thực phẩm, theo phương châm "KHÁCH QUAN – KỊP THỜI – TIN CẬY – CHÍNH XÁC”, Trung tâm Kiểm nghiệm cam kết:
Chính sách này được truyền đạt, thấu hiểu đến mọi cán bộ nhân viên của Trung tâm, là định hướng cho các hoạt động ở mọi lúc, mọi nơi .
=> Mục tiêu chất lượng cụ thể sẽ được xây dựng, ban hành hàng năm trên cơ cơ định hướng của Chính sách chất lượng và các Mục tiêu tổng quát, Kế hoạch công tác và nhiệm vụ do cấp trên giao và Trung tâm hoạch định. Ví dụ mục tiêu cụ thể năm 2021: Hoàn thành 100% kế hoạch mẫu do Sở y tế giao.
Trên cơ sở vận dụng chu trình PDCA và yêu cầu của hệ thống ISO/IEC 17025, Trung tâm tổ chức thực hiện “Đánh giá nội bộ” định kỳ hoặc đột xuất (theo QT. Đánh giá nội bộ) nhằm phát hiện những điểm chưa phù hợp, những điểm cần cải tiến để hoàn thiện công tác quản lý, chuyên môn. Sau đó, lãnh đạo Trung tâm tiến hành họp xem xét về hệ thống quản lý (theo QT. Xem xét của lãnh đạo) để đánh giá lại toàn bộ một chu kỳ vận hành hệ thống nhằm đảm bảo tính hiệu lực và duy trì có hiệu quả trong thời gian tiếp theo.
Kết quả của việc quản lý theo hệ thống là giúp cho Trung tâm hoạt động ổn định, khoa học, trong điều kiện được kiểm soát, kết quả kiểm nghiệm xuất ra bên ngoài được tin cậy, có khả năng được công nhận và thừa nhận lẫn nhau, tạo thuận lợi cho công tác quản lý chung của ngành kiểm nghiệm, người sử dụng kết quả. Kể cả trường hợp, trước đây, khi Trung tâm kiểm nghiệm có mẫu không đạt chất lượng phải kiểm nghiệm lại nhiều lần, gửi cho Viện kiểm nghiệm thẩm định mất một thời gian dài mới trả lời kết quả thì nay, Trung tâm có thể chủ động khẳng định kết quả mẫu không đạt, trả lời khách hàng và báo cáo đến các cơ quan quản lý theo quy định mà không lo ngại về mặt rủi ro bởi toàn bộ hoạt động đã được quản lý một cách có hệ thống.
Bài viết mang tính tham khảo
Công ty Đào tạo & Chuyển giao công nghệ Quản trị doanh nghiệp (IBTC)
---------------------------------------------
Quý tổ chức, PTN có nhu cầu tư vấn đào tạo, mời liên hệ:
• Công ty Đào tạo & Chuyển giao công nghệ Quản trị doanh nghiệp
• Số 03 Mỹ Đa Tây 6, P. Khuê Mỹ, Q.Ngũ Hành Sơn, TP. Đà Nẵng, Việt Nam
• Điện thoại, Zalo: 0983 088 626 ; E-mail: quantridoanhnghiepvn.dn@gmail.com
• Văn phòng M.Nam: Số 317/26/2 Đường Thống Nhất, P11, Q. Gò Vấp, TP.HCM
• Điện thoại, Zalo: 0911 787 630 ; E-mail:qtdn.kd01@gmail.com
• https://www.facebook.com/daotaoquantridoanhnghiepibtc
Hoặc đăng ký đào tạo tại đây: https://forms.gle/EozmtbL3n5k2ksji8